Química do Oficina 2015
Este é o blog da disciplina Química do 1º ano - 2015, do Colégio Oficina. Aqui você vai encontrar referências que são fundamentais para construção do conhecimento em química. Seja bem-vindo(a)!
quinta-feira, 19 de novembro de 2015
Enfim sairam as notas dos vídeos!!!
Desculpem a demora, mas, a prioridade foi fechar as notas para divulgação!
domingo, 15 de novembro de 2015
quinta-feira, 12 de novembro de 2015
terça-feira, 3 de novembro de 2015
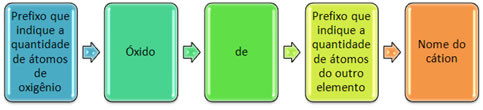
Nomenclatura de òxidos e sais
Exemplos:
CO2 = dióxido de carbono
NO = monóxido de mononitrogênio ou óxido nitroso
NO2 = dióxido de dinitrogênio ou óxido nítrico
Exemplos:
NaCl = cloreto de śodio
K2SO4 = sulfato de potássio
Funções Inorgânicas... ácidos, bases, sais e óxidos.
Para facilitar o estudo dos compostos inorgânicos, criou-se as funções inorgânicas, ou seja, grupos de famílias de compostos com características e propriedades semelhantes. Na Química Inorgânica as funções são quatro: ácidos, bases, sais e óxidos.
 |
| As principais funções inorgânicas são: ácidos, bases, sais e óxidos. |
Imagine-se chegando a um supermercado e todos os itens das prateleiras
estivessem sem nenhuma organização: massas misturadas com bebidas,
produtos de limpeza e higiene, carnes, verduras e assim por diante. Com
certeza você demoraria horas e horas para encontrar o produto desejado.
Essa ilustração nos ajuda a entender como a organização em grupos com
características semelhantes é importante e facilita a vida das pessoas.
Na Química se dá o mesmo. Com o passar do tempo e com a descoberta de
milhares de substâncias inorgânicas, os cientistas começaram a observar
que alguns desses compostos podiam ser agrupados em famílias com
propriedades semelhantes. Esses grupos são chamados de funções.
Na Química Inorgânica as quatro funções principais são: ácidos, bases, sais e óxidos.
As primeiras três funções são definidas segundo o conceito de Arrhenius.
Vejamos quais são os compostos que compreendem cada grupo:
1. Ácidos: São
compostos covalentes que reagem com água (sofrem ionização), formando
soluções que apresentam como único cátion o hidrônio, H3O+ (ou, conforme o conceito original e que permanece até hoje para fins didáticos, o cátion H+).
Exemplos:
H2SO4 → H3O+ + HSO4- ou H2SO4 → H+ + HSO4-
HCl → H3O+ + Cl- ou HCl → H+ + Cl-
1.1 Ácidos principais: Ácido Sulfúrico (H2SO4), Ácido Fluorídrico (HF), Ácido Clorídrico (HCl), Ácido Cianídrico (HCN), Ácido Carbônico (H2CO3), Ácido fosfórico (H3PO4), Ácido Acético (H3CCOOH) e Ácido Nítrico (HNO3).
2. Bases: São
compostos capazes de se dissociar na água liberando íons (dissociação), mesmo em
pequena porcentagem, dos quais o único ânion é o hidróxido, OH-.
Exemplos:
NaOH(s) → Na+ + OH-
Ca(OH)2 → Ca2+ + 2 OH-
2.1 Bases principais:Hidróxido de sódio (NaOH), Hidróxido de cálcio (Ca(OH)2), Hidróxido de magnésio(Mg(OH)2) e Hidróxido de amônio (NH4OH).
3. Sais:São
compostos capazes de se dissociar na água liberando íons, mesmo em
pequena porcentagem, dos quais pelo menos um cátion é diferente de H3O+ e pelo menos um ânion é diferente de OH-.
Exemplos:
NaCl → Na+ + Cl-
Ca(NO3)2 → Ca2+ + 2NO3-
(NH4)3PO4→ 3 NH4+ + PO43-
3.1 Sais principais:Cloreto de Sódio (NaCl), Fluoreto de sódio (NaF), Nitrito de sódio (NaNO3), Nitrato de amônio (NH4NO3), carbonato de sódio (Na2CO3), Bicarbonato de sódio (NaHCO3), Carbonato de cálcio (CaCO3), sulfato de cálcio (CaSO4), Sulfato de magnésio (MgSO4), Fosfato de cálcio (Ca3(PO4)2) e Hipoclorito de sódio (NaClO).
4. Óxidos:São compostos binários (formados por apenas dois elementos químicos), dos quais o oxigênio é o elemento mais eletronegativo.
Exemplos:
CO2, SO2, SO3, P2O5, Cl2O6, NO2, N2O4, Na2O, etc.
4.1 Principais óxidos:
4.1.1 Óxidos básicos:Óxido de cálcio (CaO) e Óxido de magnésio (MgO).
4.1.2 Óxidos ácidos:Dióxido de carbono (CO2);
4.1.3 Peróxido:Peróxido de Hidrogênio(H2O2).
domingo, 25 de outubro de 2015
Titulação
Titulação (ou Volumetria) é uma técnica comum de laboratório em análise química quantitativa, usado para determinar a concentração de um reagente conhecido. O método consiste em reagir completamente um volume conhecido de uma amostra com um volume determinado de um reagente de natureza e concentração conhecida (solução padrão).
A animação mostra uma titulação ácido-base e a respectiva curva de titulação que relaciona o pH ao volume de solução adicionada (titulante). Neste processo faz-se reagir um ácido com uma base para que se atinja o ponto de equivalência (ponto onde a reação ocorreu completamente sem excesso de regentes).
À medida que é adicionado o titulante ao titulado, o pH da solução (titulante+titulado) vai variar, sendo possível construir o gráfico desta variação (curva de titulação). O ponto de equivalência pode variar dependendo da concentração inicial do titulante e do titulado.
Normalmente, para se fazer uma titulação, utiliza-se um frasco de erlenmeyer (onde são postos o titulado, água, um indicador ácido/base) e uma bureta, onde está contido o titulante.
A titulação é um análise química que permite conhecer a quantidade de uma espécie em soluçao a partir de outra solução de outra espécie de concentração conhecida.
Pela curva de titulação, você é capaz de dizer se o liquido no erlenmayer é inicialmente ácido ou básico? E o líquido da bureta?
Pela curva de titulação, você é capaz de dizer se o liquido no erlenmayer é inicialmente ácido ou básico? E o líquido da bureta?
Assinar:
Postagens (Atom)