Este é o blog da disciplina Química do 1º ano - 2015, do Colégio Oficina. Aqui você vai encontrar referências que são fundamentais para construção do conhecimento em química. Seja bem-vindo(a)!
quinta-feira, 19 de novembro de 2015
Enfim sairam as notas dos vídeos!!!
Desculpem a demora, mas, a prioridade foi fechar as notas para divulgação!
domingo, 15 de novembro de 2015
quinta-feira, 12 de novembro de 2015
terça-feira, 3 de novembro de 2015
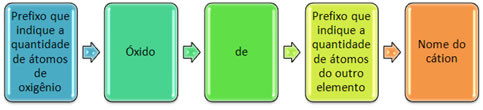
Nomenclatura de òxidos e sais
Exemplos:
CO2 = dióxido de carbono
NO = monóxido de mononitrogênio ou óxido nitroso
NO2 = dióxido de dinitrogênio ou óxido nítrico
Exemplos:
NaCl = cloreto de śodio
K2SO4 = sulfato de potássio
Funções Inorgânicas... ácidos, bases, sais e óxidos.
Para facilitar o estudo dos compostos inorgânicos, criou-se as funções inorgânicas, ou seja, grupos de famílias de compostos com características e propriedades semelhantes. Na Química Inorgânica as funções são quatro: ácidos, bases, sais e óxidos.
 |
| As principais funções inorgânicas são: ácidos, bases, sais e óxidos. |
Imagine-se chegando a um supermercado e todos os itens das prateleiras
estivessem sem nenhuma organização: massas misturadas com bebidas,
produtos de limpeza e higiene, carnes, verduras e assim por diante. Com
certeza você demoraria horas e horas para encontrar o produto desejado.
Essa ilustração nos ajuda a entender como a organização em grupos com
características semelhantes é importante e facilita a vida das pessoas.
Na Química se dá o mesmo. Com o passar do tempo e com a descoberta de
milhares de substâncias inorgânicas, os cientistas começaram a observar
que alguns desses compostos podiam ser agrupados em famílias com
propriedades semelhantes. Esses grupos são chamados de funções.
Na Química Inorgânica as quatro funções principais são: ácidos, bases, sais e óxidos.
As primeiras três funções são definidas segundo o conceito de Arrhenius.
Vejamos quais são os compostos que compreendem cada grupo:
1. Ácidos: São
compostos covalentes que reagem com água (sofrem ionização), formando
soluções que apresentam como único cátion o hidrônio, H3O+ (ou, conforme o conceito original e que permanece até hoje para fins didáticos, o cátion H+).
Exemplos:
H2SO4 → H3O+ + HSO4- ou H2SO4 → H+ + HSO4-
HCl → H3O+ + Cl- ou HCl → H+ + Cl-
1.1 Ácidos principais: Ácido Sulfúrico (H2SO4), Ácido Fluorídrico (HF), Ácido Clorídrico (HCl), Ácido Cianídrico (HCN), Ácido Carbônico (H2CO3), Ácido fosfórico (H3PO4), Ácido Acético (H3CCOOH) e Ácido Nítrico (HNO3).
2. Bases: São
compostos capazes de se dissociar na água liberando íons (dissociação), mesmo em
pequena porcentagem, dos quais o único ânion é o hidróxido, OH-.
Exemplos:
NaOH(s) → Na+ + OH-
Ca(OH)2 → Ca2+ + 2 OH-
2.1 Bases principais:Hidróxido de sódio (NaOH), Hidróxido de cálcio (Ca(OH)2), Hidróxido de magnésio(Mg(OH)2) e Hidróxido de amônio (NH4OH).
3. Sais:São
compostos capazes de se dissociar na água liberando íons, mesmo em
pequena porcentagem, dos quais pelo menos um cátion é diferente de H3O+ e pelo menos um ânion é diferente de OH-.
Exemplos:
NaCl → Na+ + Cl-
Ca(NO3)2 → Ca2+ + 2NO3-
(NH4)3PO4→ 3 NH4+ + PO43-
3.1 Sais principais:Cloreto de Sódio (NaCl), Fluoreto de sódio (NaF), Nitrito de sódio (NaNO3), Nitrato de amônio (NH4NO3), carbonato de sódio (Na2CO3), Bicarbonato de sódio (NaHCO3), Carbonato de cálcio (CaCO3), sulfato de cálcio (CaSO4), Sulfato de magnésio (MgSO4), Fosfato de cálcio (Ca3(PO4)2) e Hipoclorito de sódio (NaClO).
4. Óxidos:São compostos binários (formados por apenas dois elementos químicos), dos quais o oxigênio é o elemento mais eletronegativo.
Exemplos:
CO2, SO2, SO3, P2O5, Cl2O6, NO2, N2O4, Na2O, etc.
4.1 Principais óxidos:
4.1.1 Óxidos básicos:Óxido de cálcio (CaO) e Óxido de magnésio (MgO).
4.1.2 Óxidos ácidos:Dióxido de carbono (CO2);
4.1.3 Peróxido:Peróxido de Hidrogênio(H2O2).
domingo, 25 de outubro de 2015
Titulação
Titulação (ou Volumetria) é uma técnica comum de laboratório em análise química quantitativa, usado para determinar a concentração de um reagente conhecido. O método consiste em reagir completamente um volume conhecido de uma amostra com um volume determinado de um reagente de natureza e concentração conhecida (solução padrão).
A animação mostra uma titulação ácido-base e a respectiva curva de titulação que relaciona o pH ao volume de solução adicionada (titulante). Neste processo faz-se reagir um ácido com uma base para que se atinja o ponto de equivalência (ponto onde a reação ocorreu completamente sem excesso de regentes).
À medida que é adicionado o titulante ao titulado, o pH da solução (titulante+titulado) vai variar, sendo possível construir o gráfico desta variação (curva de titulação). O ponto de equivalência pode variar dependendo da concentração inicial do titulante e do titulado.
Normalmente, para se fazer uma titulação, utiliza-se um frasco de erlenmeyer (onde são postos o titulado, água, um indicador ácido/base) e uma bureta, onde está contido o titulante.
A titulação é um análise química que permite conhecer a quantidade de uma espécie em soluçao a partir de outra solução de outra espécie de concentração conhecida.
Pela curva de titulação, você é capaz de dizer se o liquido no erlenmayer é inicialmente ácido ou básico? E o líquido da bureta?
Pela curva de titulação, você é capaz de dizer se o liquido no erlenmayer é inicialmente ácido ou básico? E o líquido da bureta?
sexta-feira, 23 de outubro de 2015
segunda-feira, 19 de outubro de 2015
corante em uma bola de água no espaço
Se tem um lugar que quero muito realizar um experimento é dentro de uma nave com gravidade zero!!!
Veja que fantástico:
TEXTO:
Veja o incrível efeito de colocar corante em uma bola de água no espaço
Parece um ET, mas não é. Parece mágica, mas não é. A NASA divulgou mais um vídeo que mostra astronautas brincando com líquidos a bordo da Estação Espacial Internacional. Em altíssima resolução, as imagens parecem saídas de um filme.
Vídeos como os do comandante Chris Hadfield têm mostrado lados que ainda não havíamos visto da vida no espaço e, recentemente, Terry Virts foi filmado enquando lançava no ar uma bola de água flutuante com um comprimido de antiácido dentro dela. Neste vídeo recém-lançado, vemos os astronautas inserindo corante em bolas flutuantes de água. Parece simples, mas o efeito é espetacularmente bonito.
A câmera RED Epic Dragon usada para este vídeo é capaz de filmar resoluções de até 6144 x 3160 pixels e 300 quadros por segundo. Ela também foi a câmera utilizada na trilogia “O Hobbit” e está disponível comercialmente – se você é do tipo que pode gastar modestos R$ 220 mil com isso.A qualidade inacreditável da câmera significa que ela é capaz de capturar ainda mais informações que podem ajudar os astronautas com as pesquisas científicas. Aqui na Terra, no Marshall Space Flight Center, em Huntsville, nos Estados Unidos, a NASA está pensando em usar as câmeras para operações de veículos, tais como acoplagem e desacoplagem.
A agência espacial norte-americana também planeja postar vídeos 4K da EEI no seu canal do YouTube mais frequentemente.
fonte: http://hypescience.com/veja-o-incrivel-efeito-de-colocar-corante-em-uma-bola-de-agua-no-espaco/
(: tocar violão no espaço também seria demais:
quinta-feira, 8 de outubro de 2015
Vídeo sobre a ação da água
Perceba no vídeo abaixo como as moléculas de água retiram um próton da molécula da 7-azaindole:
O vídeo mostra o rompimento da ligação entre o hidrogênio e o nitrogênio da molécula da 7-azaindole e a formação da ligação de um outro hidrogênio de uma molécula de água com o outro nitrogênio da mesma molécula:
O vídeo mostra o rompimento da ligação entre o hidrogênio e o nitrogênio da molécula da 7-azaindole e a formação da ligação de um outro hidrogênio de uma molécula de água com o outro nitrogênio da mesma molécula:
As ligações que piscam entre as moléculas de água são ligações de hidrogênio!
Essas interações, que acontecem a uma velocidade muito grande e constantemente, dependem de todos os fatores que estudamos até aqui (propriedades dos elementos, polaridade, geometria molecular, interações entre as moléculas, acidez e basicidade, etc) e muitos outros que alguns de vocês poderão vir a conhecer!
Química é show!
sexta-feira, 2 de outubro de 2015
terça-feira, 22 de setembro de 2015
O MOVIMENTO HUMANO
O MOVIMENTO HUMANO
Quem está por trás disso?
Veja a figura desta postagem. Sódio, potássio, cálcio, magnésio e cloreto estão ligados à transmissão de impulsos nervosos.
Impulso nervoso é um impulso elétrico que se origina das alterações nas cargas elétricas das superfícies interna e externa da membrana plasmática. O impulso nervoso, que percorre o neurônio, é de natureza eletroquímica e resulta de modificações internas e externas da membrana neural. Internamente a membrana do neurônio possui carga elétrica negativa e externamente ela é positiva. Para que um impulso passe de um órgão receptor ao encéfalo ou do encéfalo a um órgão receptor ele necessita percorrer vários neurônios. Essa transmissão é auxiliada pelas bombas de sódio (Na+) e potássio (K+).
Cálcio e Magnésio formam importantíssimo equilíbrio entre líquidos extra e intracelulares e na contração muscular. Quando existe uma carência de Magnésio, o Cálcio, desequilibrado em relação ao Magnésio, em lugar de se fixar nos ossos, é eliminado ou deposita-se em várias partes do organismo formando, ao longo do tempo, calcificações como por exemplo: nas paredes das artérias causando a arteriosclerose, nas articulações ósseas, nos rins e na vesícula formando "pedras", "quistos" nos seios, nos pulmões, etc. além da formação de coágulos no sangue, que predispõe a tromboses provocando sintomas de perda de memória, da visão e transtornos da audição, contribuindo desta forma para o envelhecimento prematuro.
Quem está por trás disso?
Veja a figura desta postagem. Sódio, potássio, cálcio, magnésio e cloreto estão ligados à transmissão de impulsos nervosos.
Impulso nervoso é um impulso elétrico que se origina das alterações nas cargas elétricas das superfícies interna e externa da membrana plasmática. O impulso nervoso, que percorre o neurônio, é de natureza eletroquímica e resulta de modificações internas e externas da membrana neural. Internamente a membrana do neurônio possui carga elétrica negativa e externamente ela é positiva. Para que um impulso passe de um órgão receptor ao encéfalo ou do encéfalo a um órgão receptor ele necessita percorrer vários neurônios. Essa transmissão é auxiliada pelas bombas de sódio (Na+) e potássio (K+).
Cálcio e Magnésio formam importantíssimo equilíbrio entre líquidos extra e intracelulares e na contração muscular. Quando existe uma carência de Magnésio, o Cálcio, desequilibrado em relação ao Magnésio, em lugar de se fixar nos ossos, é eliminado ou deposita-se em várias partes do organismo formando, ao longo do tempo, calcificações como por exemplo: nas paredes das artérias causando a arteriosclerose, nas articulações ósseas, nos rins e na vesícula formando "pedras", "quistos" nos seios, nos pulmões, etc. além da formação de coágulos no sangue, que predispõe a tromboses provocando sintomas de perda de memória, da visão e transtornos da audição, contribuindo desta forma para o envelhecimento prematuro.
segunda-feira, 21 de setembro de 2015
Experimentos no Espaço!!!
Tente explicar as forças que atuam sobre as moleculas de água neste vídeo da NASA:
E que tal essa reação química:
E que tal essa reação química:
terça-feira, 15 de setembro de 2015
quinta-feira, 3 de setembro de 2015

Balanceamento
de equações pelo método de oxi-redução
1-Procurar
todos os elementos que possam sofrer oxi-redução e determinar o número de
oxidação antes e depois da reação;
Lembre-se
das regras práticas:
|
|
Substância
simples: nox=zero;
|
|
|
Hidrogênio:
nox=+1 (exceto hidretos metálicos - NaH, CaH2, AlH3 -
quando vale -1);
|
|
|
Oxigênio:
nox=-2 (exceto peróxidos - H2O2, CaO2 -
quando vale -1);
|
|
|
Alumínio:
nox=+3;
|
|
|
metais
alcalinos: nox=+1;
|
|
|
metais
alcalino-terrosos: nox=+2;
|
|
|
calcogênios:
nox = -2 (quando situados na extremidade direita do composto - Ag2S)
|
|
|
halogênios:
nox = -1 (quando situados na extremidade direita do composto - AgCl)
|
2-Calcular
a variação total do nox do oxidante e do redutor;.
3-Tomar
a variação do oxidante como coeficiente do redutor e vice-versa.
4-Prosseguir
o balanceamento com as regras utilizadas no método direto.
RESOLVIDO
| P + HNO3 + H2O ® H3PO4 + NO |
| 0 +5 +5 +2 |
Veja
que o fósforo (P) teve o seu nox alterado de 0 para +5, ou seja, sofreu uma
oxidação. A variação foi de 5 elétrons;
Já
o nitrogênio (N) teve o seu nox alterado de +5 para +2, ou seja, sofreu uma
redução. A variação foi de 3 elétrons.
Escolha
uma substância da oxidação e outra da redução para iniciar o balanceamento.
Neste caso vou escolher o HNO3 e o P (poderia ser as outras. Só não
devemos escolher a substância que tem o seu nox repetido em outro local da
reação (aparece mais de uma vez no reagente ou no produto e tem o seu valor
repetido em outro local da reação com o mesmo elemento).
HNO3
: 3 x 1 = 3 (é a variação dos elétrons multiplicado pela atomicidade do
elemento que sofreu a redução);
P:
5 x 1 = 5 (é a variação dos elétrons multiplicado pela atomicidade do
elemento que sofreu a oxidação);
Agora
inverta os resultados, escrevendo o coeficiente 5 para o HNO3 e
3 para o P. Veja só:
| 3P + 5HNO3 + H2O ® H3PO4 + NO |
Agora
é só completar o restante da equação, utilizando o mesmo raciocínio do
método direto ou por tentativas.
| 3P + 5HNO3 + 2H2O ® 3H3PO4 +5NO |
Demonstre
os balanceamentos de 1 a 72 pelo método de oxi-redução:
-
Al + OH-1 + NO3-1 + H2O ® AlO2-1 + NH3
-
As2S3 + HNO3 + H2O ® H2SO4 + H3AsO4 + NO
-
As2S5 + NH4OH + H2O2 ® (NH4)3AsO4 + (NH4)2SO4 + H2O
-
As2S5 + HNO3 + H2O ® H2SO4 + H3AsO4 + NO
-
AsO4-3 + Zn + H+1 ® Zn+2 + H2O + AsH3
-
Au + H2SO4 ® Au2(SO4)3 + H2
-
Au + NO3-1 + Cl-1 + H+1 ® AuCl4-1 + NO2 + H2O
-
Bi+3 + SnO2-2 + OH-1 ® SnO3-2 + H2O + Bi
-
Bi2O3 + NaClO + NaOH ® NaBiO3 + NaCl + H2O
-
Br2 + NaOH ® NaBr + NaBrO + H2O
-
Br2 + NaOH ® NaBr + NaBrO3 + H2O
-
C + HNO3 ® CO2 + NO2 + H2O
-
C2H4 + KMnO4 + H2O ® C2H4(OH)2 + MnO2 + KOH
-
Ca3(PO4)2 + SiO2 + C ® CaSiO3 + CO + P
-
CaC2O4 + KMnO4 + H2SO4 ® CaSO4 + K2SO4 + MnSO4 + H2O + CO2
EXERCICIO LIVRES PARA REVISÃO (REDOX)
Balancear as equações:
Cl2
+ H2O2 → HCl + O2
Cl2
+ NaOH → NaCl + NaClO + H2O
Cl2
+ NaOH → NaCl + NaClO3 + H2O
Cl2
+ OH-1 → Cl-1
+ ClO3-1 + H2O
Co+2
+ BrO-1 + H+1 → Co+3 + Br2 + H2O
Cr(OH)3
+ IO3-1 + OH-1 → CrO4-2 + I-1 + H2O
Cr+3
+ MnO2 + OH-1 → CrO4-2 + Mn+2 + H2O
Cr2O7-2
+ Fe+2 → Cr+3 + Fe+3
Cr2O7-2
+ H2C2O4 + H+1 → Cr+3 + CO2 + H2O
CrCl3
+ H2O2 + NaOH → Na2CrO4 + NaCl + H2O
CS2
+ H2S + Cu → Cu2S + CH4
Cu
+ HNO3 → Cu(NO3)2 + H2O
+ NO
Cu
+ HNO3 → Cu(NO3)2 + H2O
+ NO2
CuS
+ HNO3 → Cu(NO3)2 + S
+ NO + H2O
Fe
+ H3PO4 → Fe(H2PO4)2 + H2
Fe3O4
+ CO → Fe + CO2
Fe2O3
+ CO → CO2 + Fe
HBrO3
+ SO2 + H2O → Br2 + H2SO4
H2O2
+ PbO2 + H2SO4 → PbSO4 + H2O + O2
H2S
+ Br2 + H2O → H2SO4 + HBr
H2S
+ H2O2 → S + H2O
H2S
+ HNO3 → H2SO4 + NO2 + H2O
Hg
+ HNO3 → Hg(NO3)2 + H2O
+ NO
Hg
+ HNO3 → Hg(NO3)2 + H2O
+ NO2
HgS
+ HNO3 → Hg(NO3)2 + S + NO + H2O
HI
+ H2O2 → H2O + I2
HIO3
+ HI → I2 + H2O
K2Cr2O7
+ H2O + S → SO2 + KOH + Cr2O3
K2Cr2O7
+ H2O2 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
+ O2
K2Cr2O7
+ H2S + H3PO4 → K3PO4 + CrPO4 + H2O +
S
K2Cr2O7
+ HCl → KCl + CrCl3 + Cl2 + H2O
K2Cr2O7
+ KI + H2SO4 → K2SO4 + Cr2(SO4)3 + I2
+ H2O
K2Cr2O7
+ Na2C2O4 + H2SO4 → K2SO4 + Cr2(SO4)3 + Na2SO4
+ H2O + CO2
K2Cr2O7
+ FeCl2 + HCl → CrCl3 + KCl + FeCl3 + HCO2
KClO3
+ H2SO4 → HClO4 + ClO2 + K2SO4 + H2O
KClO3
+ Na2SnO2 → KCl + Na2SnO3
KMnO4
+ FeSO4 + H2SO4 → K2SO4 + MnSO4 + Fe2(SO4)3
+ H2O
KMnO4
+ H2C2O4 + H2SO4 → K2SO4 + MnSO4 + H2O + CO2
KMnO4
+ H2O2 + H2SO4 → K2SO4 + MnSO4 + H2O + O2
KMnO4
+ HCl → KCl + MnCl2 + H2O + Cl2
KMnO4
+ Na2C2O4 + H2SO4 → K2SO4 + MnSO4 + Na2SO4 +
H2O + CO2
MnO2
+ HBr → MnBr2 + Br2 + H2O
MnO2
+ HCl → MnCl2 + H2O + Cl2
MnO2
+ NaI + H2SO4 → Na2SO4 + MnSO4 + H2O + I2
MnO4-1
+ Fe+2 + H+1 → Mn+2 + Fe+3 + H2O
MnO4-1
+ I-1 + H+1 → Mn+2 + I2 + H2O
MnO4-1
+ SO3-2 + H+1 → Mn+2 + SO4-2 + H2O
NaBiO3
+ H2O2 + H2SO4 → Na2SO4 + Bi2(SO4)3 + H2O
+ O2
P
+ HNO3 + H2O → H3PO4 + NO
P4
+ HNO3 + H2O → H3PO4 + NO
SO2
+ MgO → MgSO3
SO4-2
+ Pb+2 → PbSO4
Zn
+ HNO3 → Zn(NO3)2 + NH4NO3 + H2O
Zn
+ HNO3 → Zn(NO3)2 + NH3 + H2O
ZnO
+ C → Zn + CO
Questões com respostas:
(Cesgranrio-RJ
adaptado) Tratando-se o fósforo branco (P4)
com solução aquosa de ácido nítrico, obtêm-se o ácido fosfórico (H3PO4)
e monóxido de nitrogênio (NO), segundo a equação química não-balanceada:
P4 + HNO3 + H2O → H3PO4 + NO.
Qual a soma dos coeficientes dos reagentes dessa reação? R:31
P4 + HNO3 + H2O → H3PO4 + NO.
Qual a soma dos coeficientes dos reagentes dessa reação? R:31
(Puccamp-SP)
Os filtros contendo carvão ativo, procuram eliminar o excesso de cloro na
água tratada. Pode ocorrer a reação:
Cl2 + C + H2O → CO2 + H+1 + Cl-1 .
Balanceando-se a equação com os menores números inteiros possíveis, qual a soma dos coeficientes do primeiro membro da reação? R: 5
Cl2 + C + H2O → CO2 + H+1 + Cl-1 .
Balanceando-se a equação com os menores números inteiros possíveis, qual a soma dos coeficientes do primeiro membro da reação? R: 5
(Mack-SP)
Qual a soma dos menores coeficientes inteiros do balanceamento da equação
a seguir, pelo método redox:
K2Cr2O7 + HCl →K2O + Cr2O3 + H2O + Cl2? R:15
K2Cr2O7 + HCl →K2O + Cr2O3 + H2O + Cl2? R:15
O
gás carbônico presente em extintores de incêndio não pode ser
usado para apagar o fogo provocado por sódio metálico porque o gás carbônico
reage com o metal aquecido, formando carbonato de sódio e carbono
elementar. Formule a equação que representa a reação descrita,
balanceando-a pelo método de oxi-redução.
R: 4Na + 3CO2 → 2Na2CO3 + 1C
R: 4Na + 3CO2 → 2Na2CO3 + 1C
(UERJ)
A equação Au+3 + Ag → Ag+ + Au representa uma reação possível pelo contato, em
presença de saliva, de uma obturação de outro e outra de prata. Nessa
equação, após ajustada, qual a soma de todos os coeficientes (reagentes e
produtos)? R: 8
Assinar:
Postagens (Atom)