Como presente para os que gostam de conhecer cada vez mais, encontrei este site lindo (como o próprio nome já diz!)
http://beautifulchemistry.net/reactions.html
que tem vídeos como este:
Aparatos do Laboratório de Lavoisier
Este é o blog da disciplina Química do 1º ano - 2015, do Colégio Oficina. Aqui você vai encontrar referências que são fundamentais para construção do conhecimento em química. Seja bem-vindo(a)!
sexta-feira, 24 de julho de 2015
terça-feira, 14 de julho de 2015
Ligação hidrogênio observada ao microscópio de força atômica.
Sem as ligações de hidrogênio (também conhecidas como pontes de
hidrogênio), a água e o DNA perderiam um bom número de suas
propriedades. Químicos e biólogos não podem, pois, deixar de se
interessar pela performance de uma equipe de pesquisadores chineses que
trabalham na área de nanotecnologia. Eles acabam de observar, no
microscópio de força atômica, ligações entre moléculas. Com este tipo de
instrumento, esta é a primeira vez!
Foi no início do Século XX que, vários químicos, mais ou
menos independentemente, tomaram consciência que existia uma ligação
química, à qual denominaram ligação hidrogênio. Frágil, ela é 20 vezes
mais fraca que a ligação covalente (aquela que liga os átomos nas
moléculas), porém mais forte que as ligações de van der Waals,
inicialmente identificadas nos gases. Ela deve sua existência
essencialmente às interações eletrostáticas de tipo dipolo-dipolo, mas
há uma discussão sobre a contribuição dos efeitos quânticos, normalmente
responsáveis pelas ligações covalentes.
Ora, compreender melhor a ligação hidrogênio é um dos pontos de grande interesse, uma vez que se pode considerá-la como a ligação química da vida.
De fato, ela atua na formação das estruturas tridimensionais das
proteínas (sobretudo, das ligações entre as bases do DNA), mas é também
responsável por muitas das propriedades singulares da água. Assim,
próximo de 0 0C, a água
se contrai quando aquecida e se torna mais fluida quando comprimida.
Além disso, a água é um excelente solvente para sais, ácidos e bases por
dissociar íons negativos e positivos.Do microscópio de efeito túnel ao microscópio de força atômica
Para penetrar em alguns dos segredos da ligação hidrogênio, tentou-se observá-la ao microscópio entre moléculas. Há alguns anos conseguimos, não com um instrumento comum, mas com um microscópio de efeito túnel (microscópio de varredura por tunelamento). Deve-se esta invenção, de 1981, ao Prêmio Nobel de Física Gerd Binnig e Heinrich Roher, então membros do Laboratório IBM, de Zurique (Suíça).
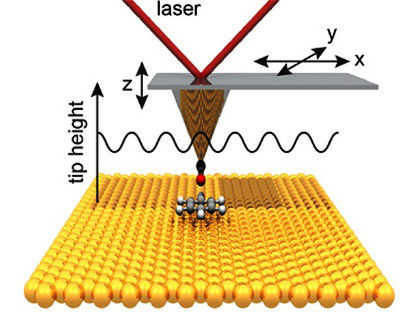
Princípio de uma medida no microscópio de força atômica em modo de ausência de contato (isto é, com uma molécula de monóxido de carbono na ponta da agulha do microscópio). É possível deduzir as variações de posição vertical, causadas pelas variações das forças exercidas pelos átomos. Destas variações, pode-se deduzir uma imagem, através de tratamento matemático.
Créditos: UC Regents.
Alguns anos depois, os dois pesquisadores fizeram o microscópio evoluir, inventando, desta vez, o microscópio de força atômica (AFM para Atomic Force Microscopy, em inglês). Recentemente, descobriu-se, por acaso, ser possível aumentar a resolução do mesmo. Bastava fazê-lo funcionar com o que, agora, é chamado "modo sem contato", isto é: interpondo-se entre a ponta do microscópio e o objeto a ser imageado uma molécula de monóxido de carbono.
Chave para compreender melhor a ligação hidrogênio
Com esse resultado, pesquisadores do National Center for Nanoscience and Technology e da Universidade de Renmin (ambas instituições chinesas) mobilizaram todo o potencial do microscópio de força atômica para explorar o mundo da ligação hidrogênio. Escolheram, como laboratório de estudo, moléculas de 8-hidroxiquinoleína, porque os átomos destas moléculas estão mais ou menos no plano. Isto tornou possível aos físicos e aos químicos obter a primeira imagem da ligação hidrogênio com um microscópio de força atômica.
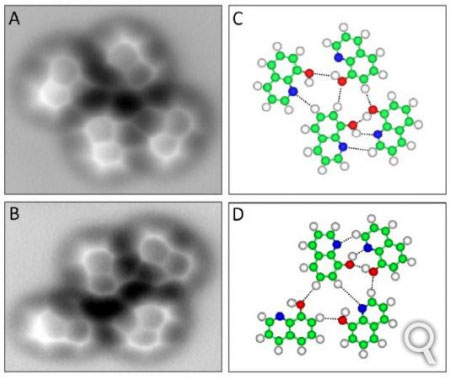
Moléculas de 8-hidroxiquinoleína. Nas imagens à direita: C
(carbono) = verde; H (hidrogênio) = branco; O (oxigênio) = vermelho e N
(nitrogênio) = azul. As ligações hidrogênio são representadas por
pontilhados. Estas moléculas, sobre uma superfície de cobre, podem ser
encontradas ligadas por ligações hidrogênio à baixa temperatura. É o que
se constata nas duas imagens à esquerda, feitas com um microscópio de força atômica.
Créditos: AAAS.
Créditos: AAAS.
Os autores ainda não são capazes de encerrar o debate, recentemente reavivado, sobre a importância da parte referente aos efeitos não puramente eletrostáticos nas ligações hidrogênio entre certas moléculas. Mas, incontestavelmente, uma "ferramenta" a mais está à disposição da comunidade científica, para avançar na direção de uma visão mais ampla e mais precisa desta ligação, tão importante para os sistemas biológicos.
Futura Sciences (Tradução -MIA).
Nota do Scientific Editor - O trabalho "Real-Space Identification of Intermolecular Bonding with Atomic Force Microscopy", que deu origem a esta notícia, é de autoria de Jun Zhang, Pengcheng Chen, Bingkai Yuan, Wei Ji, Zhihai Cheng e Xiaohui Qiu, tendo sido publicado na revista Science, on-line, 2013, DOI: 10.1126/science.1242603.
Cientistas capturam por acidente imagens inéditas de átomos se ligando
A imagem acima mostra o exato momento em que átomos fazem uma ligação covalente. É a primeira vez que este processo complexo de transformação de uma molécula foi capturado em flagrante – e por pura sorte.
Felix Fischer e sua equipe do Departamento de Energia do Laboratório Nacional de Lawrence Berkeley (EUA) tinham a intenção de fazer o que qualquer químico molecular está fazendo estes dias: criar nanoestruturas de grafeno, o “material maravilha” dos últimos tempos.
O grafeno é composto de átomos de carbono dispostos em um padrão hexagonal repetido, criando uma substância com propriedades quase mágicas (a camada única é extremamente fina, transparente, forte e ótima condutora de eletricidade).
Esse padrão exige a reorganização de átomos de uma cadeia linear a formas de seis lados – no entanto, reordenar átomos pode ser complicado e o processo pode produzir várias moléculas diferentes.
Assim, a equipe do Lawrence Berkeley decidiu dar uma olhada mais de perto nesse procedimento para se certificar de que tinha feito a coisa certa. Para tanto, eles usaram um microscópio de força atômica, uma técnica capaz de “visualizar” as forças elétricas produzidas por moléculas, gerando imagens ao nível de átomos e ligações sendo alinhados.
Eis que surgiu a imagem inédita de átomos de carbono e as ligações entre eles, criadas por elétrons compartilhados. As ligações atômicas individuais tinham, cada uma, alguns dez milionésimos de um milímetro de comprimento. O resultado final mostrou três produtos inesperados, além de uma molécula que os cientistas haviam previsto.
Enquanto as próprias imagens foram uma surpresa, o que elas mostraram não foi nada surpreendentemente. Antes da fotografia acidental, os cientistas só tinham sido capazes de inferir estruturas moleculares. No entanto, os diagramas se parecem exatamente com o que os aprendemos em aulas de química. Ou seja, é notável o fato de que eles tinham sido, até agora, baseados em estimativas e premissas (claro, com a toda lógica científica aplicada).
Os pesquisadores publicaram a descoberta na edição de 30 de maio da revista Science.[Gizmodo, Wired]

A molécula reagente, mostrada numa superfície de prata, antes do rearranjo em produtos

Produto 2 é uma das duas moléculas mais comuns produzidas

Produto 3 é uma das duas moléculas mais comuns produzidas

Produto 4 é uma molécula inesperada

A equipe previu a existência do produto 5, mas ele foi responsável por menos de 1% da mistura da reação
fonte: http://hypescience.com/cientistas-capturam-imagens-ineditas-de-atomos-de-ligando-por-acidente/
Átomos podem estar em dois lugares ao mesmo tempo
Será que uma cobrança de pênalti pode marcar um gol e perdê-lo ao
mesmo tempo? Talvez na Copa do Mundo não. Mas pelo menos para objetos
muuuuuuito pequenos, essa ideia é possível.
De acordo com as previsões da mecânica quântica, objetos microscópicos podem tomar caminhos diferentes AO MESMO TEMPO.

A equipe de Bonn desenvolveu um esquema que mede indiretamente a posição de um átomo. Em essência, procuram onde o átomo de césio não está. A imagem esclarece este procedimento. Vamos supor que dois recipientes estão em frente de nós e um gato está escondido sob um deles (a). No entanto, não sabemos em qual. Se levantamos o direito (b) e o vemos vazio, concluímos que o gato deve estar no jarro esquerdo e ainda não foi perturbado. Se levantamos a jarra esquerda em vez disso, perturbamos o gato (c), e a medição deve ser descartada. No mundo da macro-realista, este esquema de medição teria absolutamente nenhuma influência sobre o estado do gato, que permaneceria imperturbável o tempo todo. No mundo quântico, no entanto, uma medida negativa que revela a posição do gato, como em (b), já é suficiente para destruir a superposição quântica e influenciar o resultado da experiência
Mas esse nem sempre é o caso. Físicos da Universidade de Bonn fizeram um experimento para possivelmente mostrar que esta tese é falsa, pelo menos para objetos microscópicos. A primeira experiência mostra que os átomos de césio podem efetivamente tomar dois caminhos ao mesmo tempo.
Quase 100 anos atrás, os físicos Werner Heisenberg, Max Born e Erwin Schrödinger criaram um novo campo na física e o batizaram de mecânica quântica. Objetos do mundo quântico – de acordo com essa teoria – já não se movem ao longo de um único caminho bem definido. Em vez disso, eles podem tomar caminhos diferentes simultaneamente e acabar em lugares diferentes ao mesmo tempo. Os físicos se referem a esse fenômeno como superposição quântica.
Ao nível dos átomos, é como se os objetos de fato obedecessem às leis da mecânica quântica.
Ao longo dos anos, muitos experimentos confirmaram as previsões da mecânica quântica. Em nossa experiência diária macroscópica, no entanto, assistimos a uma bola de futebol voando exatamente um caminho; ela jamais entra no gol e vai para fora ao mesmo tempo. Por que isso acontece?
Objetos “grandes” jogam com regras diferentes?
Parece que sim. Mas também pode ser que as bolas de futebol obedeçam a regras completamente diferentes do que as que se aplicam para átomos individuais. “Vamos falar sobre o ponto de vista macro-realista do mundo”, explica o Dr. Alberti. “De acordo com esta interpretação, a esfera se move sempre numa trajetória específica, independente da nossa observação, e em contraste com o átomo”.
Fonte: http://hypescience.com/atomos-podem-estar-em-dois-lugares-ao-mesmo-tempo/
De acordo com as previsões da mecânica quântica, objetos microscópicos podem tomar caminhos diferentes AO MESMO TEMPO.

A equipe de Bonn desenvolveu um esquema que mede indiretamente a posição de um átomo. Em essência, procuram onde o átomo de césio não está. A imagem esclarece este procedimento. Vamos supor que dois recipientes estão em frente de nós e um gato está escondido sob um deles (a). No entanto, não sabemos em qual. Se levantamos o direito (b) e o vemos vazio, concluímos que o gato deve estar no jarro esquerdo e ainda não foi perturbado. Se levantamos a jarra esquerda em vez disso, perturbamos o gato (c), e a medição deve ser descartada. No mundo da macro-realista, este esquema de medição teria absolutamente nenhuma influência sobre o estado do gato, que permaneceria imperturbável o tempo todo. No mundo quântico, no entanto, uma medida negativa que revela a posição do gato, como em (b), já é suficiente para destruir a superposição quântica e influenciar o resultado da experiência
Mais do que os olhos podem ver
O mundo dos objetos macroscópicos segue outras regras: a bola de futebol, por exemplo, sempre tem uma ou outra direção definida.Mas esse nem sempre é o caso. Físicos da Universidade de Bonn fizeram um experimento para possivelmente mostrar que esta tese é falsa, pelo menos para objetos microscópicos. A primeira experiência mostra que os átomos de césio podem efetivamente tomar dois caminhos ao mesmo tempo.
Quase 100 anos atrás, os físicos Werner Heisenberg, Max Born e Erwin Schrödinger criaram um novo campo na física e o batizaram de mecânica quântica. Objetos do mundo quântico – de acordo com essa teoria – já não se movem ao longo de um único caminho bem definido. Em vez disso, eles podem tomar caminhos diferentes simultaneamente e acabar em lugares diferentes ao mesmo tempo. Os físicos se referem a esse fenômeno como superposição quântica.
Ao nível dos átomos, é como se os objetos de fato obedecessem às leis da mecânica quântica.
Ao longo dos anos, muitos experimentos confirmaram as previsões da mecânica quântica. Em nossa experiência diária macroscópica, no entanto, assistimos a uma bola de futebol voando exatamente um caminho; ela jamais entra no gol e vai para fora ao mesmo tempo. Por que isso acontece?
“Há duas interpretações diferentes”
É o que defende o Dr. Andrea Alberti, do Instituto de Física Aplicada da Universidade de Bonn. “A mecânica quântica permite estados de superposição de grandes objetos macroscópicos. Mas esses estados são muito frágeis”, de forma que o simples ato de nossos olhos acompanhar a trajetória já é suficiente para destruir a superposição e tornar uma determinada trajetória definida.Objetos “grandes” jogam com regras diferentes?
Parece que sim. Mas também pode ser que as bolas de futebol obedeçam a regras completamente diferentes do que as que se aplicam para átomos individuais. “Vamos falar sobre o ponto de vista macro-realista do mundo”, explica o Dr. Alberti. “De acordo com esta interpretação, a esfera se move sempre numa trajetória específica, independente da nossa observação, e em contraste com o átomo”.
Mas qual das duas interpretações é a correta?
Os objetos “grandes” se movem de forma diferente dos objetos pequenos? Em colaboração com o Dr. Clive Emary da Universidade de Hull, no Reino Unido, a equipe de Bonn surgiu com um esquema experimental que pode ajudar a responder a essa pergunta. “O desafio foi desenvolver um sistema de medição de posições dos átomos que permite falsificar teorias macro-realistas”, acrescenta Alberti.Fonte: http://hypescience.com/atomos-podem-estar-em-dois-lugares-ao-mesmo-tempo/
Veja como os átomos são ridículamente pequenos
Átomos são ridiculamente e inacreditavelmente pequenos. Um único fio
de cabelo humano é tão fino quanto 500 mil átomos de carbono
enfileirados entre si.
Olhe para seu punho, ele contem trilhões e trilhões de átomos. Se apenas cada átomo dela fosse do tamanho de uma bolinha de gude, o quão grande seu punho seria? Bem… Mais ou menos do tamanho do planeta Terra. Ainda assim é difícil de imaginar?
Vamos tentar algo diferente. Olhe para seu dedo mindinho e imagine que sua ponta é tão grande quanto a sala que você está sentado nesse momento. Agora encha essa sala com grãos de arroz, um arroz representa uma célula da ponta do seu dedo. Agora vamos ampliar esse grão de arroz e agora esse arroz é tão grande como a sala que você está agora. Vamos enche-la com arroz de novo… Esse é mais ou menos o tamanho de uma proteína. E agora, vamos encher todos os espaços vazios entre os grãos de arroz com pequenos grãos de areia. Isso é basicamente tão pequeno quanto os átomos são.

Um átomo consiste de três partículas elementares: nêutrons, prótons e elétrons. Prótons e nêutrons se juntam e formam o núcleo do átomo, que sem mantém unidos pela interação forte, uma das quatro forças fundamentais do universo.
Eles são feitos de quarks, e se mantem juntos pelos gluôns… Ninguém sabe ao certo quão pequenos são os quarks. Nos achamos que podem podem ser literalmente pontos como em geometria. Tente imagina-los como tendo zero dimensões. Nós suspeitamos que os quarks e os elétrons são os componentes fundamentais da matéria do universo.
Elétrons orbitam o núcleo do átomo, eles viajam em uma velocidade de aproximadamente 2.200 km/s. Rápido o suficiente para dar a volta na terra em apenas 18 segundos. Assim como quarks nós pensamos que os elétrons são partículas fundamentais…
O que nós sabemos sobre isso é que, na verdade, seria um espaço preenchido por flutuações quânticas, um campo que tem energia potencial que é criada e se dissolve espontaneamente. Essa flutuações tem impacto fundamental no modo como partículas carregadas interagem.

Quanto de espaço existe entre o núcleo e o elétron?
Se nós subtrairmos todo os espaços entre as partes dos átomos do Empire State Buiding ele seria tao alto quanto um grão de arroz. Todos os átomos da humanidade caberiam em uma colher de chá.
Existem objetos extremos onde situações como essas realmente existem, em uma estrelas de nêutrons o centro dos átomos são compactados tão densamente que a massa de três sois caberiam em um objeto de apenas alguns quilômetros de diâmetro.
Como é um átomo?
Bem… mais ou menos com isso:

Elétrons tem função de onda e partícula ao mesmo tempo. Nós podemos calcular aonde um elétron pode estar em certo momento no tempo. Essas nuvens de probabilidade, chamadas de orbitais, é aonde elétrons podem estar com uma precisão de 95%. A probabilidade de achar um elétron se aproxima de 0 conforme nos afastamos do centro do átomo mas na verdade ela nunca é zero, o que significa que, em teoria, um elétron de um átomo pode estar do outro lado do universo.
OK. Espere um segundo, essa coisa estranha compõe toda a matéria do universo para algumas dúzias de elementos conhecidos na tabela periódica, e você não precisa de muitas dúzias de partículas elementares.
Apenas três. Pegue um próton e um elétron, e você tem hidrogênio. E um próton e um nêutron, você tem hélio. E com alguns a mais, você tem carbono, mais alguns flúor, ainda mais, ouro e por ai vai. Cada átomo de um elemento é igual.
Todos os átomos de hidrogênio no universo, por exemplo, são iguais. O hidrogênio no seu corpo é exatamente o mesmo hidrogênio de dentro do sol.
Está se sentindo confuso agora? Nós certamente estamos! Nada nessa escala do universo faz algum sentido no nosso mundo. E nós nem começamos a falar sobre mecânica quântica ou sobre o zoológico de partículas que são ainda mais estranhas.
Nosso modelo de átomos tem mudado inúmeras vezes desde que nos criamos a primeira e a atual com certeza não vai ser a ultima. Então vamos apoiar os cientistas e pesquisas e esperar pela nova onda de incríveis novas informações sobre esse mundo estranho que é a base de nossa existência.
fonte: http://hypescience.com/veja-como-os-atomos-sao-ridiculamente-pequenos/
Olhe para seu punho, ele contem trilhões e trilhões de átomos. Se apenas cada átomo dela fosse do tamanho de uma bolinha de gude, o quão grande seu punho seria? Bem… Mais ou menos do tamanho do planeta Terra. Ainda assim é difícil de imaginar?
Vamos tentar algo diferente. Olhe para seu dedo mindinho e imagine que sua ponta é tão grande quanto a sala que você está sentado nesse momento. Agora encha essa sala com grãos de arroz, um arroz representa uma célula da ponta do seu dedo. Agora vamos ampliar esse grão de arroz e agora esse arroz é tão grande como a sala que você está agora. Vamos enche-la com arroz de novo… Esse é mais ou menos o tamanho de uma proteína. E agora, vamos encher todos os espaços vazios entre os grãos de arroz com pequenos grãos de areia. Isso é basicamente tão pequeno quanto os átomos são.
Do que um átomo é feito?
Vamos dizer por um minuto que os átomos se pareçam com isso, assim fica mais fácil de se entender:
Um átomo consiste de três partículas elementares: nêutrons, prótons e elétrons. Prótons e nêutrons se juntam e formam o núcleo do átomo, que sem mantém unidos pela interação forte, uma das quatro forças fundamentais do universo.
Eles são feitos de quarks, e se mantem juntos pelos gluôns… Ninguém sabe ao certo quão pequenos são os quarks. Nos achamos que podem podem ser literalmente pontos como em geometria. Tente imagina-los como tendo zero dimensões. Nós suspeitamos que os quarks e os elétrons são os componentes fundamentais da matéria do universo.
Elétrons orbitam o núcleo do átomo, eles viajam em uma velocidade de aproximadamente 2.200 km/s. Rápido o suficiente para dar a volta na terra em apenas 18 segundos. Assim como quarks nós pensamos que os elétrons são partículas fundamentais…
99.999 999 999 999% do volume de um átomo é somente espaço vazio…
Só que não.O que nós sabemos sobre isso é que, na verdade, seria um espaço preenchido por flutuações quânticas, um campo que tem energia potencial que é criada e se dissolve espontaneamente. Essa flutuações tem impacto fundamental no modo como partículas carregadas interagem.

Quanto de espaço existe entre o núcleo e o elétron?
Se nós subtrairmos todo os espaços entre as partes dos átomos do Empire State Buiding ele seria tao alto quanto um grão de arroz. Todos os átomos da humanidade caberiam em uma colher de chá.
Existem objetos extremos onde situações como essas realmente existem, em uma estrelas de nêutrons o centro dos átomos são compactados tão densamente que a massa de três sois caberiam em um objeto de apenas alguns quilômetros de diâmetro.
Como é um átomo?
Bem… mais ou menos com isso:

Elétrons tem função de onda e partícula ao mesmo tempo. Nós podemos calcular aonde um elétron pode estar em certo momento no tempo. Essas nuvens de probabilidade, chamadas de orbitais, é aonde elétrons podem estar com uma precisão de 95%. A probabilidade de achar um elétron se aproxima de 0 conforme nos afastamos do centro do átomo mas na verdade ela nunca é zero, o que significa que, em teoria, um elétron de um átomo pode estar do outro lado do universo.
OK. Espere um segundo, essa coisa estranha compõe toda a matéria do universo para algumas dúzias de elementos conhecidos na tabela periódica, e você não precisa de muitas dúzias de partículas elementares.
Apenas três. Pegue um próton e um elétron, e você tem hidrogênio. E um próton e um nêutron, você tem hélio. E com alguns a mais, você tem carbono, mais alguns flúor, ainda mais, ouro e por ai vai. Cada átomo de um elemento é igual.
Todos os átomos de hidrogênio no universo, por exemplo, são iguais. O hidrogênio no seu corpo é exatamente o mesmo hidrogênio de dentro do sol.
Está se sentindo confuso agora? Nós certamente estamos! Nada nessa escala do universo faz algum sentido no nosso mundo. E nós nem começamos a falar sobre mecânica quântica ou sobre o zoológico de partículas que são ainda mais estranhas.
Nosso modelo de átomos tem mudado inúmeras vezes desde que nos criamos a primeira e a atual com certeza não vai ser a ultima. Então vamos apoiar os cientistas e pesquisas e esperar pela nova onda de incríveis novas informações sobre esse mundo estranho que é a base de nossa existência.
fonte: http://hypescience.com/veja-como-os-atomos-sao-ridiculamente-pequenos/
sexta-feira, 10 de julho de 2015
Fique esperto ou esperta!
Para quem acompanha o blog, tenho uma dica:
o 1° questionário de revisão da 2ª unidade está postado e já pode ser respondido!
Quem não acompanha só vai saber disso na próxima semana!
Aproveitem
o 1° questionário de revisão da 2ª unidade está postado e já pode ser respondido!
Quem não acompanha só vai saber disso na próxima semana!
Aproveitem
terça-feira, 7 de julho de 2015
Fotos mostram beleza escondida das reações químicas
Máquinas
fotográficas de última geração foram usadas para fazer os registros
BBC BRASIL.com
Um projeto feito por universidades
chinesas quer trazer a beleza da química para o público geral. Para isso, os
pesquisadores lançaram mão de máquinas fotográficas de última geração
computação gráfica.
O projeto, chamado Beautiful
Chemistry ("Linda Química", em tradução livre), também incluiu alguns
alimentos, como o registro da reação entre uma casca de ovo e ácido clorídrico,
que gerou bolhas de dióxido de carbono.
O projeto foi idealizado por
professores das faculdades do Instituto de Tecnologia Avançada da Universidade
da China e da Universidade de Tsinghua.
Fotos: Yan Liang/Design Raação
Química: Xiangang Tao, Wei Juang e Yan Liang/BeautifulChemistry.net
Ao reproduzir a reação entre cloreto
de cobalto e silicato de sódio, os pesquisadores querem fazer a química ir além
dos nomes complicados. "Se o resultado (desse projeto) for fazer mais
crianças e estudantes se interessarem por química e mudar a imagem negativa em
relação a ela, vamos ficar extremamente felizes", disseram.

Um precipitado verde de hidróxido de
níquel é gerado ao se misturar uma solução de sulfato de níquel a outra de
hidróxido de sódio

Nesta foto há o registro da reação
entre uma casca de ovo e ácido clorídrico, que gerou bolhas de dióxido de
carbono

Esta foto mostra a reação entre o
metal zinco e o nitrato de chumbo, realizada em meio a uma espécie de gel

Esta foto abstrata mostra, na verdade, a cristalização
de sulfato de cobre

Algumas gotas de sulfato de cobre
misturadas a uma solução de hidróxido de sódio geram um precipitado de sulfato
de cobre com uma coloração azul brilhante

A reação entre gás de cloreto de
hidrogênio e de amônia gera uma fumaça branca de cloreto de amônia

Esta foto mostra que gotas de nitrato
de prata em uma solução de
tiossulfato de sódio geraram um precipitado laranja
de tiossulfato
de prata

A imagem retrata um repolho roxo, que ficou vermelho ao reagir com
ácido clorídrico

Ao se misturar algumas gotas de
nitrato de cádmio em uma solução de sulfeto de sódio, o que se tem é um
precipitado amarelo de sulfeto de cádmio
Assinar:
Postagens (Atom)

